注目の製品情報
2020/10/01
iPS細胞からT細胞、NK細胞へ誘導する革新的なアプローチ「STEMdiff T Cell Kit、STEMdiff NK Cell Kit」
- 用途別細胞培養
免疫系で重要なリンパ球であるT細胞とNK細胞はいずれも末梢血から分離できますが、これらの免疫細胞を大量に供給するためにはiPS細胞などの多能性幹細胞から培養する必要があります。それにより細胞生物学やがん免疫の研究に役立つツールが提供できるようになります。
ヒト多能性幹細胞(hPSC、ヒトES/iPS細胞)から血球系細胞へ誘導する革新的な製品として、STEMCELL Technologies社ではSTEMdiff™ T Cell Kit(商品コード:ST-100-0194)とSTEMdiff™ NK Cell Kit(商品コード:ST-100-0170)を開発しました。
培養にフィーダー細胞や血清を一切使用せず、T細胞とNK細胞をそれぞれ高効率に分化誘導できる市販キット初の製品です。
注)上記製品は、StemSpan™ T Cell Generation Kit(商品コード:ST-09940)とは互換性がありません。
T細胞・NK細胞の機能と培養
ナチュラルキラー(NK)細胞とT細胞は、病原体と腫瘍に対する防御を提供するリンパ球です。NK細胞は、炎症性サイトカインの分泌、および、癌性またはウイルス感染細胞の殺傷能力により、自然免疫において重要な役割を果たします。
T細胞は、適応免疫の一部として、抗原特異的T細胞受容体(TCR)を介して広範囲の標的を認識し、サイトカイン分泌や細胞殺傷などのエフェクター機能を発揮します。T細胞の重要な特徴は免疫記憶細胞(メモリー細胞)の形成であり、再感染への応答を一次応答よりもはるかに速く確立するのに役立ちます。
がんやその他の疾患の治療においても、NK細胞やT細胞を用いた方法が有力視されてきましたが、これらの細胞を患者から十分に確保するのは技術とコストの面で困難です。iPS細胞などの多能性幹細胞からリンパ球を作製すれば、NK細胞やT細胞を無限に供給できるようになります。しかし、従来の培養系では重要な分化過程をサポートできず、フィーダー細胞や血清などの不明確な因子に依存していることが課題でした。
STEMdiff T Cell KitおよびSTEMdiff NK Cell Kitは、新たに開発された2ステップの培養法によってヒト多能性幹細胞からT細胞およびNK細胞を作製します。フィーダー細胞や血清を使用せず、複数の細胞株から再現性良く分化できることが確認されています。
STEMdiff T Cell・NK Cellの特長
STEMdiff T Cell Kit
- 均一性 ― AggreWell™で均一な細胞凝集体を作製してばらつきを低減
- 安定的 ― 無血清・フィーダーフリーの培養条件により、血清やフィーダー細胞による変動要素を排除
- 高収量 ― iPS細胞由来CD34+細胞1個あたり、NK細胞を約210個、ダブルポジティブ(DP)T細胞を約60個産生
- 簡便 ― フィーダー細胞を継代する手間を回避
注目ポイント:EB形成による分化効率アップ

STEMdiff T Cell・NK Cellの40日間の培養プロトコルでは、ステップ1でhPSCからCD34+細胞を、ステップ2でCD34+細胞からT細胞またはNK細胞を分化誘導します。
ステップ1では、iPS細胞からのCD34+細胞の誘導効率を改善するため、胚葉体(embryoid body; EB)を形成して3次元培養を行います。AggreWell™を用いて均一なEBを形成することは、再現性の向上にもつながります。
AggreWell™を動画で見る>>
STEMdiff T Cell・NK Cellのアプリケーション
- iPS細胞からNK細胞またはTリンパ系細胞への分化の研究
- 薬剤開発における、NKまたはT細胞分化に対する候補治療薬の有効性・毒性評価
- 細胞治療開発向けの、NKまたはT細胞使用の研究
- NKまたはT細胞関連疾患のin vitro 研究モデル
- NKまたはT細胞への分化前に多能性幹細胞を遺伝子編集
STEMdiff T Cell・NK Cellの使用方法
プロトコル概要
T細胞とNK細胞はどちらも40日間の培養後に回収され、培養プロトコルは2段階に分けられます。
初めの12日間でhPSCをCD34+細胞に誘導し(ステップ1)、次の28日間でCD34+細胞からT細胞またはNK細胞に分化します(ステップ2)。詳細はマニュアル(技術資料の項)もご参照ください。
ステップ1:CD34+造血前駆細胞の誘導(EB形成による3D培養)
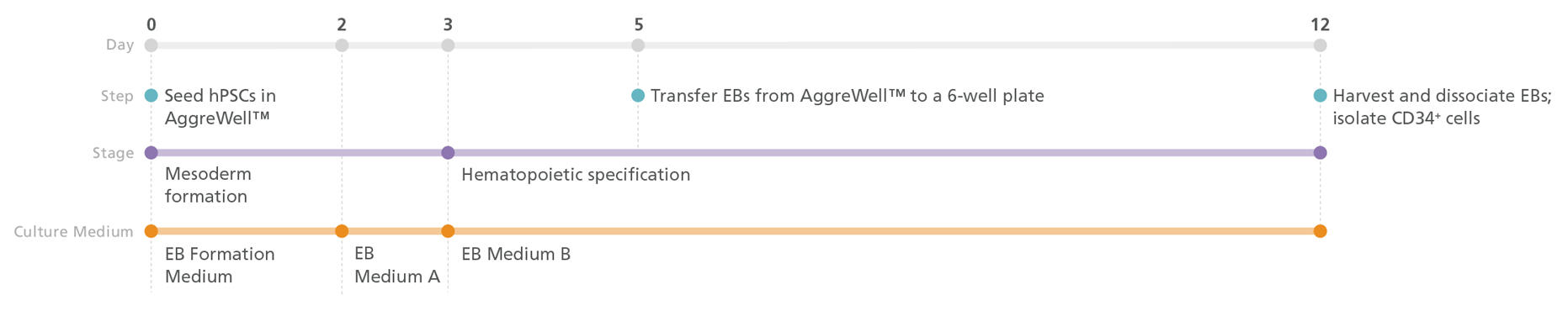
図1. iPSまたはES細胞を回収して単一細胞懸濁液に解離し、EB形成培地(EB Medium A +10 μM Y-27632)をもちいてAggreWell™プレートに播種し、500細胞の凝集体を形成させます。
3日間の中胚葉形成段階の後、培地をEB Medium Bに交換して造血系統への分化を誘導します。
5日目に、胚葉体(EB)を組織培養用コーティング非処理プレートへ移します。
12日目にEBを回収して解離し、EasySep™ Human CD34 Positive Selection Kit IIによってCD34+細胞を濃縮します。
注)ステップ1は、STEMdiff T Cell・NK Cellに共通です。この後、T Cellは ステップ2-A、NK Cellは ステップ2-Bに進みます。
ステップ2-A:T細胞の分化(2D培養)
STEMdiff T Cell KitによるT細胞分化
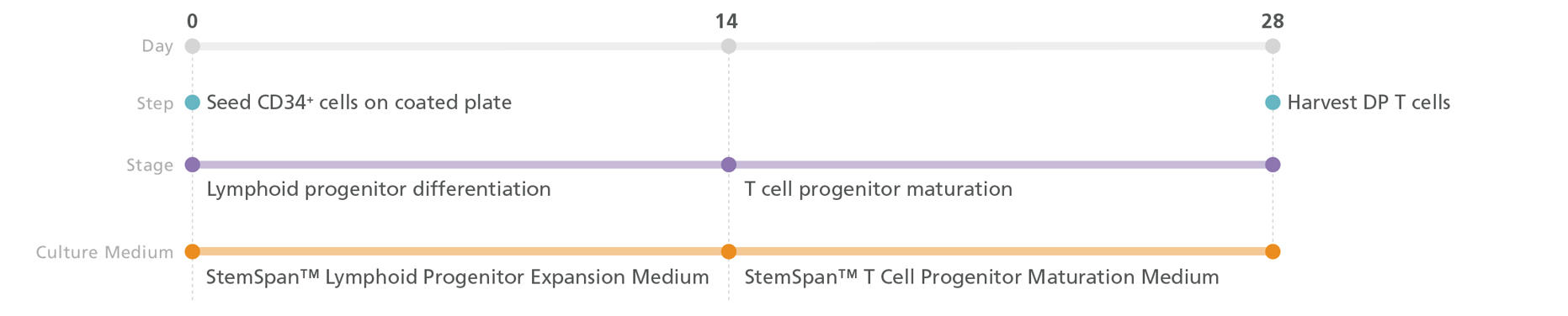
図2. iPSまたはES細胞由来のCD34+細胞を、StemSpan™ Lymphoid Differentiation Coating Materialでコーティングされたプレート上にStemSpan™ Lymphoid Progenitor Expansion Mediumをもちいて播種します。14日目にリンパ系前駆細胞の段階で回収し、CD4+CD8+ダブルポジティブ(DP)T細胞にさらに分化させるためにStemSpan™ T Cell Progenitor Maturation Mediumに再播種します。28日目にDP T細胞を回収します。
CD8+シングルポジティブ(SP)T細胞成熟

図3. 28日目に回収したダブルポジティブ(DP) T細胞(図2)を、StemSpan™ Lymphoid Differentiation Coating Materialでコーティングしたプレート上に、ImmunoCult™ T Cell Activatorを添加したCD8 SP T Cell Maturation Mediumをもちいて播種します。7日目にCD8 SP T細胞を回収します。
注)このプロトコルはオプションです。
ステップ2-B:NK細胞の分化(2D培養)
STEMdiff NK Cell KitによるNK細胞分化
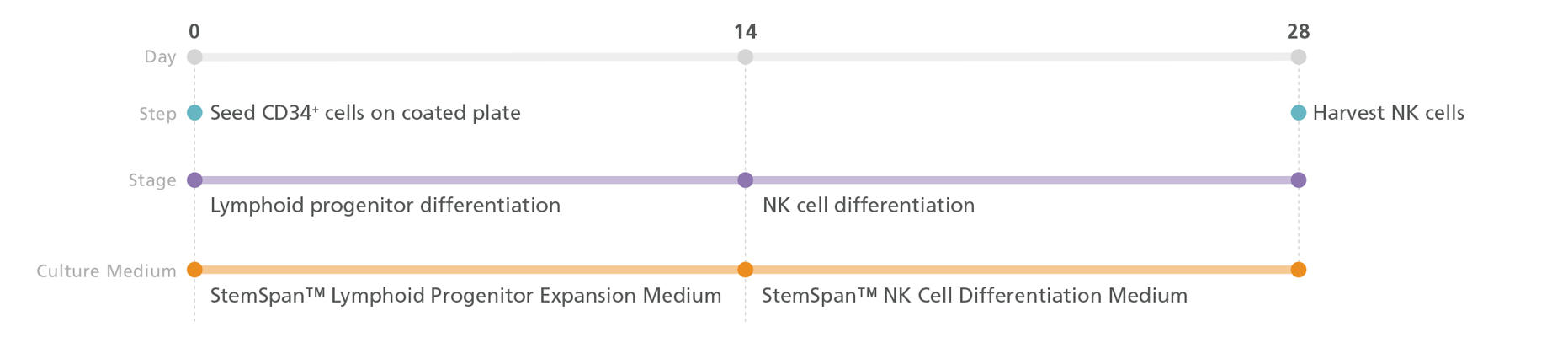
図4. iPSまたはES細胞由来のCD34+細胞を播種したのちに、StemSpan™ Lymphoid Differentiation Coating Materialでコーティングしたプレート上に、StemSpan™ Lymphoid Progenitor Expansion Mediumをもちいて培養します。
14日目にリンパ系前駆細胞を回収し、NK細胞にさらに分化させるためにUM729を添加したStemSpan™ NK Cell Differentiation Mediumに再播種します。28日目にNK細胞を回収します。
STEMdiff T Cell・NK Cellのデータ
造血系への分化
hPSCからCD34+造血前駆細胞を純度30-40%で取得

図5. ヒトESおよびiPS細胞を12日間培養し、CD34+細胞に分化誘導しました(図1)。細胞を回収し、フローサイトメトリーによりCD34とCD144の発現を分析しました。光散乱とDRAQ7™染色により死細胞は除外しました。CD34+細胞の平均頻度は、31%~42%の範囲でした。
6ウェルのAggreWell™ 400プレートの1ウェルあたりのCD34+細胞の平均収量は、3.3 x 105〜7.3 x 105の範囲でした。データは平均±SEMで示しています(n = 7-22)。
CD34+細胞から14日間でCD5+CD7+リンパ系前駆細胞を取得

図6. hPSC由来CD34+細胞を、StemSpan™ SFEM II + StemSpan™ Lymphoid Progenitor Expansion Supplementで、StemSpan™ Lymphoid Differentiation Coating Materialでコーティングしたプレート上で14日間培養しました(図2、4)。
細胞を回収し、フローサイトメトリーによりCD7とCD5の発現を分析しました。14日目の生存するCD7+CD5+リンパ系前駆細胞の平均頻度は40%~58%の範囲で、培養を開始したCD34+細胞あたりのリンパ球前駆細胞の平均収量は11~22でした。データは平均値±SEM(n = 5-21)で示しています。
T細胞分化
CD34+細胞から28日間でCD4CD8 DP T細胞を取得

図7. hPSC由来CD34+細胞を28日間培養し、DP T細胞を分化しました(図2)。
細胞を回収し、フローサイトメトリーによりCD3、CD4、CD8、およびTCRαꞵの発現を分析しました。生存するCD4CD8 DP T細胞の平均頻度は24%~58%の範囲で、培養を開始したCD34+細胞あたりのDP T細胞の平均収量は7~120でした。データは平均値±SEMで示しています(n = 3-13)。
CD4CD8 DP T細胞からCD8 SP T細胞に成熟

図8. hPSC由来CD34+細胞を28日間培養して分化したDP T細胞(図2)を、さらに7日間の成熟プロトコルで培養しCD8 SP T細胞に成熟させました(図3)。
細胞を回収し、フローサイトメトリーによってCD3、CD4、CD8、およびTCRαꞵの発現を分析しました。3つの細胞株におけるCD3+TCRαβ+CD4-CD8+(CD8 SP)T細胞の平均頻度は4%〜7%でした。データは平均値±SEMで示しています(n = 3-4)。
NK細胞分化
CD34+細胞から28日間でCD56+ NK細胞を取得

図9. hPSC由来CD34+細胞を28日間培養し、NK細胞を分化しました(図4)。
細胞を回収し、フローサイトメトリーによりCD56とCD16の発現を分析しました。生存するCD56+ NK細胞の平均頻度は81%~95%の範囲でした。培養を開始したCD34+細胞あたりのCD56+細胞の平均収量は、112〜332でした。データは平均値±SEMで示しています(n = 4-13)。
技術資料
製品詳細や必要物品は、マニュアルをご参照ください。
詳細なプロトコルおよびデータは、以下のページでもご紹介しています。





