ラーニングコーナー
2024/04/22
造血幹細胞移植後の再発・生着不全の検出ー高感度・高精度キメリズム解析の有用性ー
- 移植・HLA・MHC
キメリズム解析は、造血幹細胞を移植した患者の移植後モニタリングのため、国内外で広く利用されている手法です。レシピエント(患者)の移植後の状態を評価するために有用な検査ですが、再発や生着不全の兆候をいち早くとらえるには高感度・高精度な方法を用いることが有用です。
本ページでは高感度・高精度なキメリズム解析に有用な「細胞分離」と「高感度解析法」について紹介しています。
キメリズム解析とは
キメリズム解析は、造血幹細胞移植(同種移植)を行ったレシピエント(患者)の血液細胞において、ドナー由来の遺伝子とレシピエント由来の遺伝子の割合(キメリズム%)を決定する検査のことです。移植前はレシピエント由来の細胞しか存在しませんが、移植後はドナーと患者、両者に由来する細胞が混合した状態(混合キメラ)となります。
ドナーの細胞が正常に生着すると、ドナー由来の細胞のみとなります(完全キメラ)。しかしドナーの細胞の割合が増加しないと生着不全となります。また、移植後の時間経過でレシピエント由来の細胞が増加すると再発となります。
キメリズム解析でレシピエントドナーの細胞割合を経時的に観察することで、生着の状態や再発、腫瘍細胞の有無をモニタリングすることができます。現在件数が増加しているさい帯血移植の場合、生着までの期間が長く生着不全となる割合が高いと言われているため、キメリズム解析により生着しているかどうかの長期モニタリングが必要となります。また、HLA半合致移植(ハプロ移植)の場合、移植後に発生する移植片対宿主病(GVHD)のリスクが高くなります。キメリズム解析を行うことでこのような移植成績に関連する情報も得ることができるため、移植医療において非常に重要な検査の一つです。
【移植後の細胞の変化とキメリズム解析の模式図】

キメリズム解析で使われる手法や検体の種類
キメリズム解析で使われる手法
キメリズム解析には主に染色体を用いる手法と、遺伝子マーカーを用いる手法に大別されます。それぞれ検出マーカー数や感度などの特長が異なります。
| 手法 | 検出マーカー | 感度 | メリット | デメリット |
| FISH法(異性間FISH) | X/Y染色体 | 1-5% | 保険点数が算定されている |
異性間の移植でのみ可能 検査に多数の細胞が必要 |
| STR(Short tandem repeat)-PCR法 |
遺伝子のリピート領域 (12-24箇所) |
1-5% |
マーカー識別率が高い 必要DNA量が少ない |
マーカー選定や解析を手動で行う必要 (自動解析ソフトウェアが無い) |
| qPCR(定量PCR)法 |
SNP/indel (10-50箇所) |
0.01-0.1% |
高感度 測定時間が短い |
高%での正確性が低い 必要DNA量が多い |
| ddPCR(デジタルPCR)法 |
indel (10-30箇所) |
0.01-0.1% |
高感度・高精度 定量可能 |
判別可能なマーカーが限られる 必要DNA量が多い |
| NGS(Next generation sequencing)法 |
SNP/indel (24-210箇所) |
0.01-1% |
高感度・高精度 多検体対応 |
導入・運用コスト高 操作が煩雑 |
(Blouin et al., Hum Immunol. 2021 82:838-849の表より改変、加筆)
キメリズム解析に使用する検体の種類
解析には末梢血あるいは骨髄液が使用されます。末梢血の方が侵襲性が低くモニタリングでの採取が容易です。一方骨髄液は、採取が困難ですが骨髄細胞の状態を反映しているため、より早期に腫瘍細胞を検出可能という利点があります。ただし骨髄液の方が診断的有用性の高い検体とは限りません。例えば末梢血ではT細胞集団が骨髄液よりも高い割合で検出できます。
よりレシピエントの状態を反映した検査を行うには、検体の種類の他に、解析を実施する頻度や解析対象となる細胞種を考慮する必要があります。
ベリタスが提案する高感度・高感度キメリズムアッセイ法
EasySep(STEMCELL Technologies社)を使ったlineage specificキメリズム解析
EasySepはカラムを必要としない免疫磁気細胞分離試薬です。全血や骨髄血などのキメリズム解析用の検体からわずか15分で目的の細胞をポジティブ分離することが可能です。分離した細胞はフローサイトメトリーやDNA解析に直接用いることができ、特定の細胞種に着目したキメリズム解析(lineage specificキメリズム解析)を行えます。
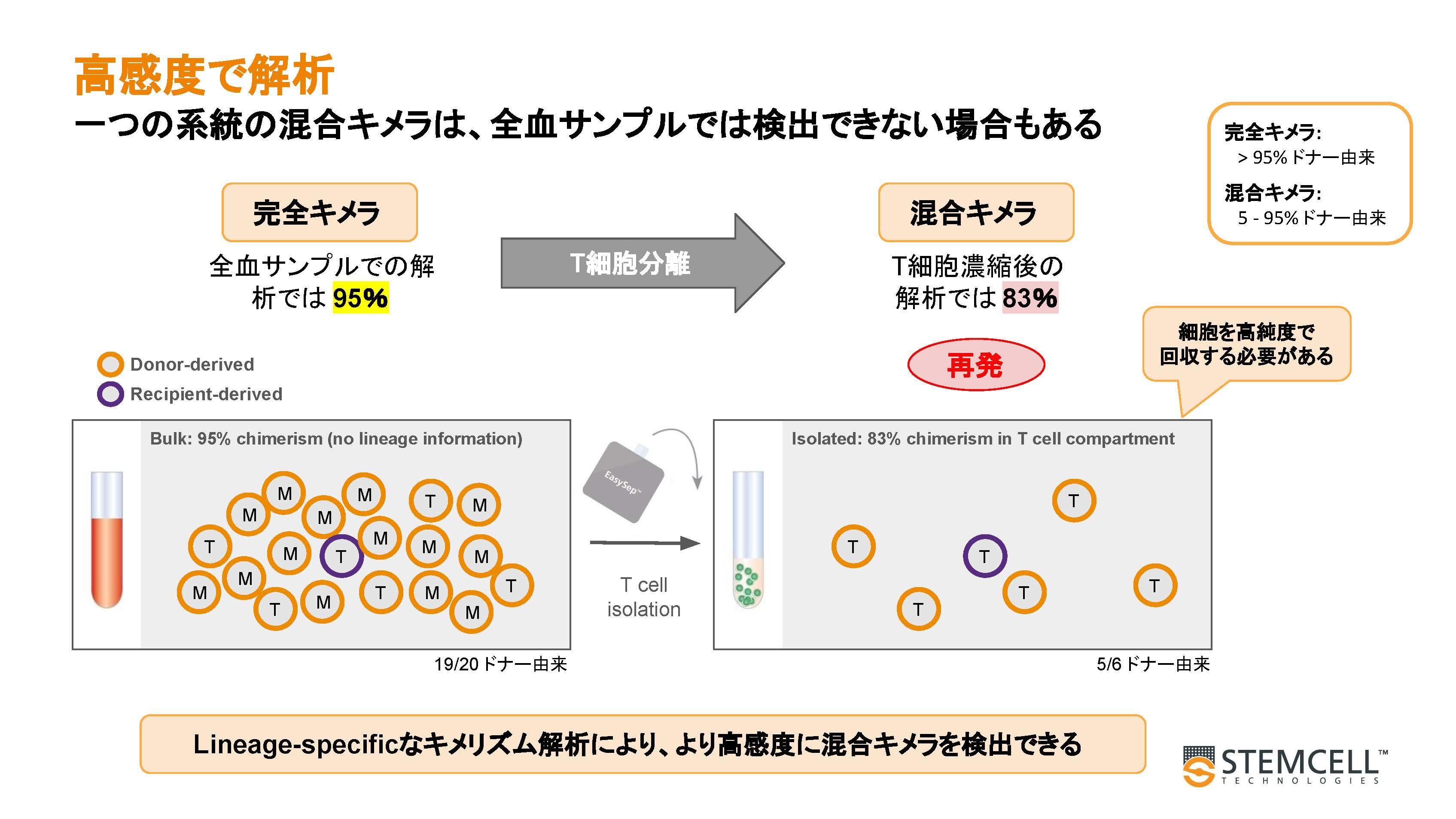
EasySepはキメリズム解析の対象とする細胞種やスタート時の検体の違いにより、最適な試薬が提供されています。
|
細胞種 |
対象マーカー |
スタートサンプル |
|
|
全血、バフィーコート |
単核細胞(全血、骨髄液由来) |
||
|
T細胞 |
CD3 |
||
|
B細胞 |
CD19 |
||
|
CD19/CD20 |
- |
||
|
骨髄系細胞 |
CD15 |
||
|
CD33 |
|||
|
CD33/66b |
- |
||
|
顆粒球 |
CD66b |
- |
|
|
単球 |
CD14 |
||
|
NK細胞 |
CD56 |
||
|
造血幹細胞 |
CD34 |
||
細胞分離による特定細胞の濃縮例
全血からEasySep™ HLA Whole Blood CD3+ Positive Selection Kit(ST-17871)を使用してCD3陽性T細胞を分離しました。T細胞の割合が分離前の18.2%から98.1%に増加しました。

EasySep試薬を活用したキメリズム解析のご紹介(研究者の声)
EasySep試薬を使用し、異なる種類の検体(末梢血・骨髄血)から同じワークフロー、かつ高精度のキメリズム解析を実施可能なプロトコルを確立した、国内の先生の研究をご紹介しています。
同種造血幹細胞移植後 CD34+ キメリズム解析の検討 研究者の声【42】
One Lambda Devyser Chimerim NGS(OneLambda)を使った高感度キメリズム解析
Devyser Chimerim NGSは、次世代シーケンサー(NGS)使ったキメリズム解析試薬です。造血幹細胞移植のスクリーニング検査(ドナーおよびレシピエントに存在するユニークな遺伝子マーカーを同定)、モニタリング検査(移植後レシピエントに存在するドナー細胞の割合を測定)両方を高感度に測定することが可能です。
- NGS(Illumina社の次世代シーケンサー)を利用したシンプルかつ簡単な試薬:ハンズオン45分、2日以内に結果取得
- 1ウェルで検体中の24マーカーを増幅
- スクリーニング検査、モニタリング検査の両方を同じプロトコルで実施可能
- 高い検出感度と精度:検出限界(LOD95/LOQ95)0.05%、検出範囲0.05~100%
- 専用ソフトウェアで迅速な解析
One Lambda Devyser Chimerism NGS製品ページはこちら
One Lambda Devyser Chimerism NGSでマイクロキメリズムを検出した例
臨床検体を含む422検体をDevyser Chimerism NGSを使って解析したところ、LODが0.1%となったことが示されました。また移植後再発を来たした6症例では、NGS法を使用することによりSTR法でキメリズムを検出できた時期よりもさらに早い段階(1%以下)のマイクロキメリズムを検出することができています。
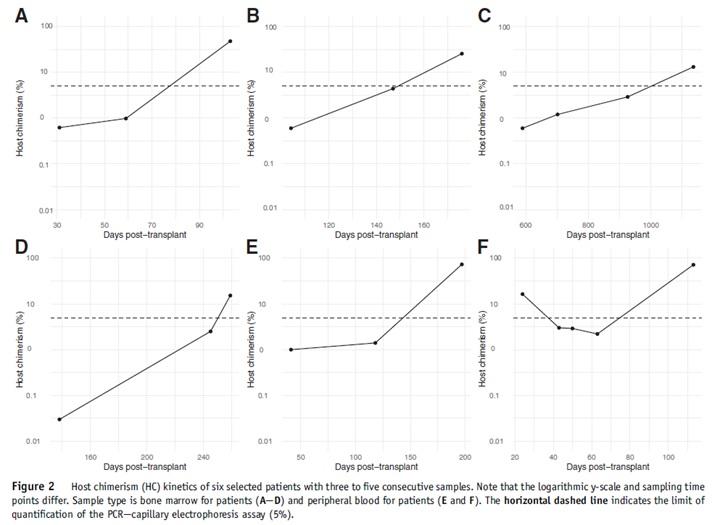
(Vynck et al., J Mol Diagn., 2021)
また、下記の報告では急性骨髄性白血病(AML)において、細胞分離によってCD33陽性細胞(骨髄系細胞)を濃縮した後、Devyser Chimerism NGSを使用したキメリズム解析を行っています。
移植後60日以内のレシピエントDNAの割合が0.2%未満となった患者は、0.2%を超えた患者に比べて再発割合が低いことが示されています。
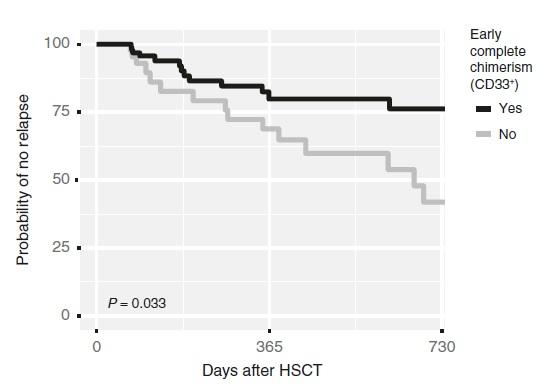
(Lindahl et al., Bone Marrow Transplant., 2022)
lineage specificキメリズム解析を行うメリット
特定の細胞サブセット内のキメリズムを調べること(lineage specificキメリズム解析)はいくつかの利点があります。
- 検査感度の向上
移植後レシピエントの末梢血や骨髄液にはドナー由来の細胞とレシピエント由来の細胞が混ざって含まれています。レシピエントが特定の細胞系列にしかキメラを認めない場合、未分画サンプル(全血)ではその割合が低すぎて検出限界以下となる可能性があります。細胞分離で濃縮することにより、キメラを検出できる可能性があります。 - 臨床的な情報の提供
特定の細胞種の挙動が臨床的なアウトカムと関連することが示されています。例えばT細胞サブセットにおけるキメリズムの検出は、疾患再発のリスク上昇と関連することが報告されています。
海外におけるlineage specificキメリズム解析の実施例
ASHIやEFIのガイドラインでは、細胞分離を行ってキメリズム解析を行う場合に文書化する、といった記載があります(海外のガイドラインについてはこちらを参照ください)。2019年にASHI/EFI認定施設を対象に行ったアンケート調査の結果が論文として発表されています(Blouin et al., 2021)。アンケート調査では、多くの施設(77%)で未分画の検体に加え、細胞分離を行ったうえでのキメリズム解析を実施していました。もっとも解析に使われていた細胞種はT細胞(CD3陽性細胞)や骨髄系細胞ですが、B細胞やNK細胞、CD34陽性細胞を対象として解析を実施している施設もありました。

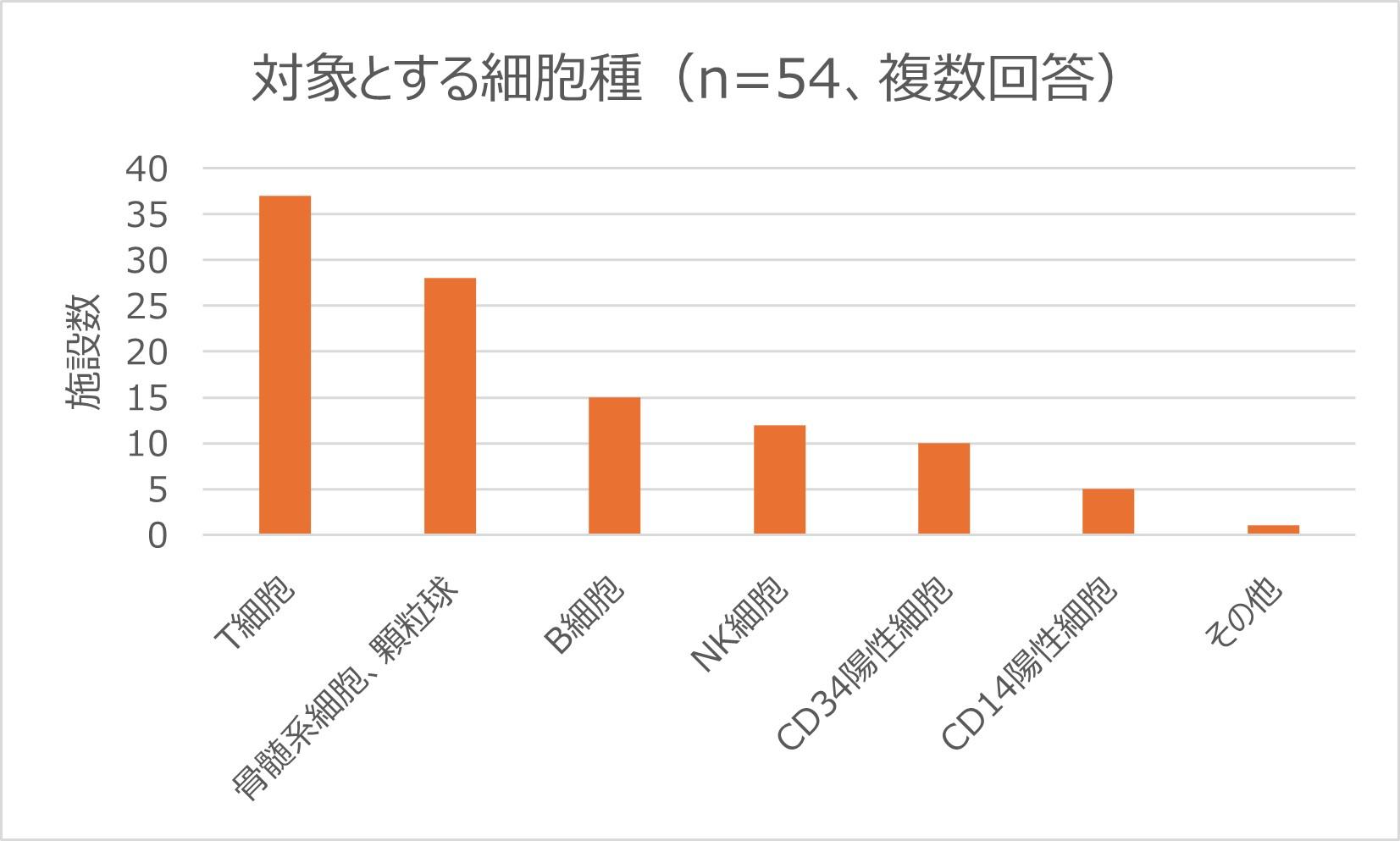
(Blouin et al., 2021より作図)
lineage specificキメリズム解析では、検体採取から細胞分離、解析までできるだけ簡便・迅速に実施することが求められます。とくに病理学的サンプルでは白血球の数や割合が健常サンプルとは異なっている可能性があるため、他の細胞種の混入をできるだけ避け、特定の細胞を高純度に取得することが重要となります。
高感度アッセイを行うメリット
キメリズム解析の目的は移植後のMRD(測定可能残存病変または微小残存病変)の有無をモニタリングし、拒絶や再発の可能性を見出すことです。
MRDの増加は悪性腫瘍の増加、つまり臨床的再発につながる可能性が高くなります。このため低いレベル、とくに1%以下のMRD(マイクロキメリズム)のモニタリングがその後の予後や治療方針に重要と考えられます。
しかし現在主に使われているSTR法の感度は1-5%のため、NGS法などのより高感度な手法を使ってマイクロキメリズムを検出する必要があります。

(Devyser社資料より抜粋)
高感度・高精度キメリズム解析を行うことにより、造血幹細胞移植後の早期診断・治療の開始につながることが期待されます。
関連製品
-

One Lambda Devyser Chimerism NGS
-

EasySep HLA Chimerism Whole Blood Lymphoid Positive Selection Kit
-
EasySep HLA Chimerism WB CD8 Positive Selection Kit
-
EasySep HLA Chimerism WB CD4 Positive Selection Kit
-

EasySep HLA Chimerism WB B Cell Positive Selection Kit
-
EasySep HLA Chimerism Whole Blood CD66b Positive Selection Kit
-

EasySep HLA Chimerism Buffy Coat CD14 Positive Selection Kit
-
EasySep HLA Chimerism Whole Blood CD33 Positive Selection Kit
-
EasySep HLA Chimerism Whole Blood CD15 Positive Selection Kit
-

EasySep HLA Chimerism Whole Blood Myeloid Positive Selection Kit
-
EasySep HLA Chimerism Whole Blood CD3 Positive Selection Kit
-
EasySep HLA Chimerism Whole Blood CD19 Positive Selection Kit
-
EasySep HLA Chimerism Buffy Coat CD56 Positive Selection Kit
